¡Hola! ¡Hola! mis queridas estudiantes
Navegando por la Web
pude observar que existe mucho material sobre el átomo y sus modelos a través
de la historia así que como veremos este tema dentro del área de CTA las invito
a navegar junto conmigo yendo por la senda de la historia del átomo
Mirando
a través de la historia los Modelos atómicos
Antes de iniciar
nuestro viaje a través de la historia es necesario definir que es un MODELO.
Pues bien al decir modelo hablamos de una representación gráfica que nos
permite entender de manera sencilla algo.
Ahora bien viajaremos desde su inicio reconociendo que
cada modelo atómico mostrado servirá para entender cuál fue la idea que se
tenía de cada uno de ellos en un tiempo determinado, así que de manera sucinta
podemos dar una cronología del átomo
1º
La materia está formada por unidades
indivisibles
2º
Átomos esféricos, indivisibles e
inmutables
3º
Esfera positiva con cargas negativas
incrustadas
4º
Núcleo positivo y electrones girando
alrededor
5º
Los electrones giran en niveles definidos
6º
Introducción a la mecánica cuántica
El átomo siempre fue la
unidad de la materia y la química como ciencia se encarga de estudiarla
Un
ejemplo es necesario para comprender las ideas iniciales del átomo
Si
tengo un trozo de materia —el que sea— y comienzo a partirlo en pedazos cada
vez más pequeños y vuelvo a partir los pedazos que me queden una y otra vez,
llegará el momento en que tenga partículas que ya no se podrán partir más.
¿Qué
me podéis decir a esto?
...pues
imagino que muchas ideas
En la historia del átomo consideraré
3 etapas
1era
Etapa Antigua-- 460 al 370 a.c (antes de Cristo). en este periodo tenemos a DEMOCRITO DE ABDERA filósofo y científico que expuso
algunas ideas que tenía sobre el átomo
·
El
átomo es demasiado pequeño como para poder verlo
·
El
átomo es indivisible como su nombre lo indica
·
El
átomo es sólido (no hay espacio vacío dentro de él)
·
Los
átomos son eternos porque son perfectos
·
Los
átomos están rodeados por un espacio vacío (para explicar sus movimientos y
cambios de densidad)
·
Los
átomos tienen un número infinito de formas (para explicar la diversidad
observada en la naturaleza)
LA MODERNA TEORÍA ATÓMICA DEL SIGLO XIX
En la 2da Etapa
Clásica a inicios del siglo XIX
El inglés
John Dalton 1808. Crea la
moderna “Teoría atómica”, propone la idea básica del átomo con base científica y
decía lo siguiente:
- La materia está formada por partículas pequeñísimas llamadas
"átomos".
- Estos átomos no se pueden dividir ni romper, no se crean ni
se destruyen en ninguna reacción química, y nunca cambian.
- Los átomos de un mismo elemento son iguales entre sí,
tienen la misma masa y dimensiones; por ejemplo, todos los átomos de hidrógeno
son iguales.
- Los átomos de elementos diferentes son diferentes; por
ejemplo, los átomos de oxígeno son diferentes a los átomos de hidrógeno.
- Los átomos pueden combinarse para formar compuestos
químicos. Por ejemplo, los átomos de hidrógeno y oxígeno pueden combinarse para
formar moléculas de agua.
- Los átomos, al combinarse para formar compuestos guardan
relaciones simples.
- Los átomos de elementos diferentes se pueden combinar en
proporciones distintas y formar más de un compuesto.
Además un nuevo sistema de símbolos químicos para los elementos dándoles
números químicos según su peso
En 1897, por su parte el
físico inglés Joseph John Thomson al realizar experimentos sobre los rayos
catódicos dio lugar para el descubrimiento del electrón y propuso un modelo
para la estructura del átomo. Thomson se dio cuenta de que los electrones
tenían carga "negativa" y pensó entonces que el resto de la materia
tenía una carga "positiva". Según Thomson, el átomo consistía en una
esfera con carga positiva que se encontraba incrustada por electrones, de carga
negativa. Su modelo lucía como pasas pegadas en la superficie de un trozo de
pastel.
1.
¿Qué experimentos hizo J.J. Thomson para llegar a descubrir al
electrón? ¿Cómo investigó la naturaleza de los rayos catódicos?
La siguiente
secuencia muestra el Modelo, experimento
y argumentos en contra de Thompson
En 1911, un físico de Nueva Zelanda llamado Ernest
Rutherford descubrió el núcleo del átomo.
Su nuevo modelo del átomo estaba formado por
dos partes: núcleo y corteza.
En la corteza es el espacio inmenso en donde los
electrones se movían rodeando el núcleo y el núcleo es la parte más pequeña del
átomo y contiene la mayor cantidad de masa
Su “experimento de la lámina de oro”, realizado en 1911. Utilizo una fina lámina de
oro como objetivo para rayos alfa, es decir, un flujo de partículas
formadas por núcleos ionizados de Helio-4 (4He), o lo que es lo mismo,
partículas positivas que carecen de electrones, que eran disparadas hacia la
lámina de oro. El experimento de Rutherford tenía como objetivo el estudio de
efecto que producía en los diferentes metales la trayectoria de dichos rayos.
Rutherford pensó entonces que el electrón se
movía alrededor del núcleo atómico como los planetas alrededor del Sol, y que
la atracción de la fuerza eléctrica jugaba el mismo rol que la gravedad juega
para los planetas; de aquí es donde se adoptó el nombre de "modelo atómico
planetario
Veamos un vídeo demostrativo del Experimento de
Ernest Rutherford
Ahora observen lo que paso en esta gráfica
Ahora observemos un vídeo que nos explica muy claramente la experiencia de rutherford
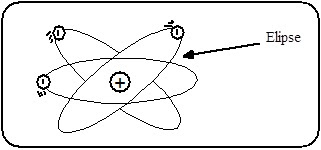
En 1913, un nuevo modelo atómico, llamado modelo atómico de Bohr o
también conocido como de Bohr-Rutherford, el cual puede ser considerado el
precedente del modelo atómico actual. Se trata de un modelo más que nada
funcional, ya que no habla del átomo en sí, sino que da explicación a su
funcionamiento mediante ecuaciones.
En
el modelo de Bohr se introdujo ya la teoría de la mecánica
cuántica que pudo explicar cómo giraban los electrones
alrededor del núcleo del átomo. Los electrones al girar
entorno al núcleo definían
unasórbitas circulares estables
que Bohr explicó como que los
electrones se pasaban de unas órbitas a otras para ganar o perder energía.
Demostró que cuando un electrón pasaba de una órbita más externa a
otra más interna emitía radiación electromagnética. Cada órbita tiene un nivel
diferente de energía.
Postulados
- El electrón se mueve en torno al núcleo formando órbitas circulares. El espacio que está en torno al núcleo se dice que está cuantizado, lo que significa que, hay partes, o zonas permitidas, conocidas como niveles, y otras que no. Si un electrón no cambia de órbita, no cambia tampoco su energía.
- Las orbitas permitidas son en las que, el momento angular del electrón ( mvr), es múltiplo de h/2π de donde h es la constante de Planck. m v r = n. h/ 2π , de donde n es el número cuántico principal, y determina los niveles entorno al núcleo, numerados a partir del núcleo, n= 1,2,3,… , lo que significa que la energía y los radios de las órbitas están cuantizados.
- Cuando un átomo emite o absorbe energía, lo realiza mediante cuantos completos de valor h.ν , y esto es debido a que el electrón experimenta un tránsito entre niveles, que se puede resumir en :
E2 – E1 = hν
De donde, E1= energía del nivel inicial y E2 = energía del
nivel final.
-El
átomo absorbe energía si E2 > E1
-El átomo emite energía si E2 < E1
-El átomo emite energía si E2 < E1
El modelo atómico que Bohr propuso, explicaba los espectros
de emisión de los elementos y afirmaba la expresión empírica que había
conseguido Rydberg. Explicaba el núcleo del átomo de hidrógeno con un protón en él, y girando a su alrededor un
electrón. El modelo que Bohr creó llevando su nombre, partía de la idea del
modelo de Rutherford, usando
conceptos estudiados por Max Planck y Einstein, años antes.
Gracias a lo simple que es este modelo, aún en la actualidad se usa para resumir la estructura de la materia.
Gracias a lo simple que es este modelo, aún en la actualidad se usa para resumir la estructura de la materia.
SOMMERFELD:
Arnold
Sommerfeld, en 1916, hizo una modificación inmediata; propuso que los
electrones, como tienen el mismo tipo de carga (-), forman campos magnéticos
iguales, por lo tanto se repelan: Luego no pueden tener orbitas circulares,
sino órbitas elípticas, introduciendo así un nuevo concepto: "El
desdoblamiento de cada nivel de energía en subniveles de energía".
MODELO ATÓMICO ACTUAL:
El
austríaco Erwin Schrodinger, en 1926, sustentó la base principal para la
concepción del modelo atómico actual.
Empleó
la mecánica ondulatoria y diseño un modelo matemático para el átomo, que está
de acuerdo con el principio de incertidumbre de Heinsenberg, pues no describe
con exactitud la posición del electrón como establece el modelo de Bohr, sino
que permite calcular matemáticamente, con una ecuación, en qué región del
espacio debe encontrarse el electrón. A esta región del espacio se le llama
"orbital"; por lo tanto, el electrón no circula por una órbita, sino
que se mueve ondulatoriamente alrededor del núcleo en una región del espacio
atómico denominado orbital, produciendo una nube electrónica negativa.
NATURALEZA ONDULATORIA DE LOS ELECTRONES
(DE BROGLIE):
En 1924, Louis de Broglie
sugirió la idea de que el electrón es una partícula en movimiento que lleva
asociada una longitud de onda, relacionada con la velocidad y la masa del
electrón.
donde: l = longitud de onda (en metros)
h
= constantes de Planck = 6, 627x 10 –34 j. s
m
= masa (en kg),
v = velocidad (en m/s)
HEINSENBERG Y EL PRINCIPIO DE INCERTIDUMBRE:
Hoy en día se habla del
electrón como de una nube de carga negativa, que se extiende ocupando una
región relativamente grande, y no tanto como de una partícula. Dicha nubes es
densa, espesa, en las regiones del espacio en las que se dé elevada
probabilidad de encontrarse el electrón, y más tenue o difusa en las de poca
probabilidad.
Heisenberg propuso en 1926 su famoso:
Principio de Indeterminación: "Es
imposible conocer exactamente y al mismo tiempo la velocidad y la posición de
un electrón aislado".
Las regiones alrededor del
núcleo donde es mucho más probable encontrar el electrón se denominan orbitales.















Casino | Las Vegas, NV - Mapyro
ResponderEliminarSearch for Casino near 제주 출장마사지 me 군포 출장샵 on 안양 출장마사지 Mapyro. Find addresses, see 과천 출장샵 activity, directions, and reviews of popular attractions in 전라남도 출장샵 Las Vegas, NV.