Hola Chicas!
Hoy después de cierto tiempo regreso a trabajar en este blog y espero que les sirva en su tarea...
El propósito de este tema radica en reconocer la existencia de partículas fundamentales dentro del átomo.
¿Cuáles son?
¿cómo se descubrieron?
...imagino que algunas de ustedes ya saben la respuesta sin embargo será bueno recrear los hechos
Imaginar que los primeros representantes de la química
como Demócrito de Abdera comunicaron al mundo que la materia se dividía
hasta llegar a un punto donde ya no podía dividirse más; con el transcurso del tiempo se comprobó que
esa parte tan chiquita de nombre átomo aún puede dividirse en partículas más
pequeñas
Pues empecemos por hablar el electrón y de cómo entre 1833 a 1875 se fue concibiendo
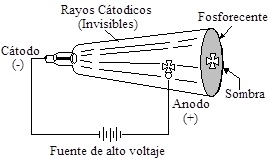
EL ELECTRÓN – Rayos Catódicos:
haz de electrones
· M.
Faraday, (1833), determinó la relación cuantitativa que existe entre la
cantidad de electricidad que se usa en la electrólisis y la cantidad de
reacción química que se origina. Años después, intentó pasar corriente
eléctrica en gases atrapados en una ampolla de vidrio, observando una
fosforescencia que se extendía del ánodo hasta las cercanías del cátodo.
· En base
a aquellos estudios, Stoney (1874), sugiere que las unidades de carga eléctrica
están asociadas con los átomos.
· J.
Plucker (1858) y luego Crookes (1875), usando tubos de descarga con mejores
vacíos, observaron que la luminiscencia en el ánodo se debía a rayos emitidos
por el cátodo, cuyas características son: 1°) viajan en línea recta; 2°) se
forman independientemente de la naturaleza de los electrodos y del gas
enrarecido atrapado en el interior del tubo; 3°) son de naturaleza eléctricamente
negativa y pueden ser desviados por un campo magnético.
Los rayos catódicos se
originan en el cátodo y se propagan en Línea recta hacia el electrodo contrario
· Stoney
(1891), propone que a las partículas negativas que constituyen los rayos
catódicos se les llame electrones.
· J.J.
Thompson (1897), usando un tubo de descarga o tubo de Crookes, al cual le
adaptó un campo eléctrico y un campo magnético, determino la relación masa/
carga del electrón, cuyo valor actual es:
e/m = - 1,7588 x 108 coulomb/ gramos ……………… (1)
Se le
considera el descubridor del electrón.
· R.
Millikan (1909), con su "experimento de la gota de aceite", logró
determinar la carga del electrón, de actual valor:
e
= - 1,602 x 10-19 Coulomb
Simultáneamente
al reemplazar este valor en la relación (1), descubierta por Thompson, se halla
la masa del electrón:
m = 9,109 x 10-28 gramos
EL PROTÓN –
Rayos Canales: haz de protones
Goldstein (1886), quien dio el nombre a los rayos
catódicos, realizó experimentos en tubos de descarga que tenían el cátodo
perforado y observó que mientras los rayos catódicos se dirigían hacia el
ánodo, otros rayos se abrían paso a través de los agujeros del cátodo, saliendo
en sentido contrario. A éstos se les llamó "rayos canales" y las
investigaciones posteriores demostraron que estaban constituidos de partículas
positivas.
Tubo de descarga mostrando la dirección en que se
desplazan los rayos canales, contrariamente a loa rayos catódicos
· W. Wein
(1898) usando un tubo de descarga similar al Thompson, determinó la relación
carga/ masa de las partículas positivas. En este caso, y a diferencia de los
electrones, los valores de e/m dependían del tipo de gas presente en el tubo de
descarga. Cuando se usa hidrógeno gaseoso, resulta la partícula positiva con
menor masa (valor e/ m más grande) que cualquier otro ión positivo; de este
modo se escogía a esta relación, como la base, para caracterizar a las
partículas positivas:
e/ m =+ 9,579 x 104 C/ g ……………………… (2)
· Rutherford
sugirió el nombre de "protón" para esta partícula. Si los átomos son
neutros, entonces la carga del protón es idéntica a del electrón, aunque de
signo contrario, luego:
carga
de e- = carga de p+ = + 1, 602 x 10-19 C que reemplazando en (2), se
obtiene la masa del protón:
m = 1,6726 x
10-24 g
C. NEUTRÓN
En 1932,
durante unos experimentos de bombardeo con partículas a, a
átomos de berilio, Chadwick, logra descubrir una partícula de masa muy similar
a la del protón, pero eléctricamente neutra y a ala que se le llamó neutrón. Al conocerse este
descubrimiento, Heisenberg sugiere que son las uniones protón – neutrón las que
constituyen el núcleo de las partículas alfa. Esta idea posteriormente se
extrapoló para todo núcleo atómico, idea que se acepta hasta hoy.
uma: unidad de masa atómica,
es a 1/ 12 parte de la masa del isótopo
C –12, al cual arbitrariamente se le asignó la masa de 12 u ó uma. 1 uma (u) = 1,660531 x 10-27 kg.